- نحوه ی دسترسی به پایان نامه های دانشگاه های مختلف جهان
- کاغذ لیتموس برای شناسایی غذاهای فاسد
- وجود سلنیم در خون مادر از ورود سم به بدن جنین جلوگیری میکند
- تعادل شیمیایی-شیمی تجزیه
- اثزدما بر تعادل-شیمی تجزیه رشته صنایع شیمیایی
- اثر دما بر انحلال پذیری-شیمی تجزیه رشته صنایع شیمیایی
- آدرس فیسبوک سایت
- چگونه برف درست کنيم
- دودزا
- نارنجک با پرمنگنات پتاسيم
آخرین مطالب
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 323 تاريخ : چهارشنبه 30 آذر 1390 ساعت: 2:59
تقطير
روشهای مختلفی برای جداسازی مواد اجزای سازنده یک محلول وجود دارد که یکی از این روشها فرایند تقطیر میباشد در روش تقطیر جداکردن اجزاء یک مخلوط ، از روی اختلاف نقطه جوش آنها انجام میگیرد .تقطیر ، در واقع ، جداسازی فیزیکی برشهای نفتی است که اساس آن ، اختلاف در نقطه جوش هیدروکربنهای مختلف است. هر چه هیدروکربن سنگینتر باشد، نقطه جوش آن زیاد است و هر چه هیدروکربن سبکتر باشد، زودتر خارج میشود.
تقطير
روشهای مختلفی برای جداسازی مواد اجزای سازنده یک محلول وجود دارد که یکی از این روشها فرایند تقطیر میباشد در روش تقطیر جداکردن اجزاء یک مخلوط ، از روی اختلاف نقطه جوش آنها انجام میگیرد .تقطیر ، در واقع ، جداسازی فیزیکی برشهای نفتی است که اساس آن ، اختلاف در نقطه جوش هیدروکربنهای مختلف است. هر چه هیدروکربن سنگینتر باشد، نقطه جوش آن زیاد است و هر چه هیدروکربن سبکتر باشد، زودتر خارج میشود.
تقطیر در عمل به دو روش زیر انجام میگیرد. روش اول شامل تولید بخار از طریق جوشاندن یک مخلوط مایع ، سپس میعان بخار ، بدون اینکه هیچ مایعی مجددا به محفظه تقطیر بازگردد. در نتیجه هیچ مایع برگشتی وجود ندارد. در روش دوم قسمتی از بخار مایع شده به دستگاه تقطیر باز میگردد و به صورتی که این مایع برگشتی در مجاورت بخاری که به طرف مبرد میرود قرار میگیرد. هر کدام از این روشها میتوانند پیوسته یا ناپیوسته باشند.
تقطیر، معمولترین روشی است که برای تخلیص مایعات به کار می رود. دراین عمل مایع را به کمک حرارت تبخیر می کنند و بخار مربوطه را در ظرف جداگانه ای متراکم می کنند و محصول تقطیر را بدست می آورند. چنانچه ناخالصیهای موجود در مایع اولیه فرار نباشند، در باقی مانده تقطیر به جا می مانند و تقطیر ساده جسم را خالص میکند. در صورتی که ناخالصیها فرار باشند، تقطیر جزء به جزء مورد احتیاج خواهد بود.
چنانچه ناخالصي هاي موجود در مايع اوليه فرار نباشد در باقيمانده تقطير به جا مي ماند و تقطير ساده نمونه را خالص مي كند. در صورتيكه فرار باشند تقطير جز به جز مورد نياز خواهد بود. اگر فقط يك ماده فرار بوده و اختلاف نقطه ي جوش اين ماده با ناخالصي هاي موجود در آن زياد باشد (حدود 30 درجه) مي توان براي جدا كردن اين ماده از ناخالصي ها از تقطير ساده استفاده نمود. از تقطير ساده معمولا در جداسازي مخلوط مايعاتي استفاده مي شود كه نقطه ي جوشي در محدوده 40 تا 150 درجه دارند زيرا در دماي بالاتر از 150 درجه بسياري از تركيبات آلي تجزيه مي شوند ودر دماي جوش كمتر از 40 درجه مقدار زيادي از مايع در ضمن تقطيرهدر مي رود.
در تقطير مخلوطي ازدو يا چند جسم فشاربخار كل تابعي از فشار بخار هر يك از اجزا و كسر مولي آنه مي باشد. بر اساس قانون رائول فشار بخار جزيي يك تركيب فرار در يك محلول ايده آل با حاصلضرب فشار بخار در كسر مولي آن برابر است. بنابراين در بخار موجود بر سطح دو يا چند جز محلول فرار ذرات كليه اجزا شركت كننده در محلول يافت مي شود. رابطه بين فشار بخار كل (Pt) با فشار جزيي (Pi) و كسر مولي اجزا (Xi) به صورت زير است:
...+Pt = PaXa + PbXb + PcXc
اگر در محلولي شامل دو ماده شيميايي فرار يك جز داراي فشار بخار بيشتري از جز ديگر باشد بخار حاصل از آن در مقايسه با مايع داراي درصد بيشتري از جسم فرارتر خواهد بود.
ظروف معمولي در خلل و شكاف هاي جدار خود داراي بسته ها ي هواي محبوس مي باشند. با ريختن مايع در ظرف محفظه بسته ها از بخار پر مي شود. وقتي كه دماي مايع افزايش مي يابد بخار آنقدر به حالت متراكم باقي مي ماند تا اينكه از فشار بخار روي مايع بيشتر شود در اين حالت بخار به دام افتاده افزايش حجم پيدا مي كند و به صورت حباب هايي به سطح مايع رسيده و خارج مي گردد. حالت به هم خوردگي حاصل از حباب ها (جوش) حباب هاي هواي بيشتري را به داخل مايع كشانده و فرايند با تشكيل بخار ادامه مي يابد.
با حرارت دادن مايعات درظروف شيشه اي كه داراي سطوحي نسبتا صاف و يكنواخت مي باشند حالت جوش ايجاد نمي شود و اگر درجه حرارت به اندازه كافي افزايش يابد به حالت انفجاري تبخير مي گردند. براي اجتناب از خطرات مربوط به جوشش ناگهاني (به صورت ضربه اي) منبعي براي دميدن حباب ها به درون مايع قبل از حرارت دادن و عمل جوش لازم است. در شرايط معمولي (فشارجو) اين منبع سنگ جوش مي باشد. سنگ جوش دانه هايي حاوي خلل ريز در خود بوده كه در آن مولكولهاي هوا حبس شده اند. با قرار گرفتن اين دانه ها در محلول حباب ها از سطح آنها تشكيل شده و از جوشيدن انفجاري و تاخير در جوش جلوگيري مي نمايد.
انواع تقطیر :
تقطير ساده:
به عنوان مثال هنگاميكه ناخالصي غير فراري مانند شكر به مايع خالصي اضافه مي شود فشار بخار مايع تنزل مي يابد. علت اين عمل آن است كه وجود جز غير فرار به مقدار زيادي غلظت جز اصلي فرار را پايين مي آورد يعني ديگر تمام مولكولهايي كه در سطح مايع موجودند مولكولهاي جسم فرار نيستند و بدين ترتيب قابليت تبخير مايع كم مي شود.
تقطير ساده را مي توان به دوصورت تعريف كرد :
تقطير ساده غير مداوم
تقطير ساده مداوم
تقطیر ساده غیر مداوم :
در این روش تقطیر ، مخلوط حرارت داده میشود تا بحال جوش درآید بخارهایی که تشکیل میشود غنی از جزء سبک مخلوط میباشد پس از عبور از کندانسورها ( میعان کننده ها ) تبدیل به مایع شده ، از سیستم تقطیر خارج میگردد. به تدریج که غلظت جزء سنگین مخلوط در مایع باقی مانده زیاد میشود، نقطه جوش آن بتدریج بالا میرود. به این ترتیب ، هر لحظه از عمل تقطیر ، ترکیب فاز بخار حاصل و مایع باقی مانده تغییر میکند.
تقطیر ساده مداوم :
در این روش ، مخلوط اولیه (خوراک دستگاه) بطور مداوم با مقدار ثابت در واحد زمان ، در گرم کننده گرم میشود تا مقداری از آن بصورت بخار درآید، و به محض ورود در ستون تقطیر ، جزء سبک مخلوط بخار از جزء سنگین جدا می شود و از بالای ستون تقطیر خارج میگردد و بعد از عبور از کندانسورها ، به صورت مایع در میآید جزء سنگین نیز از ته ستون تقطیر خارج میشود. قابل ذکر است که همیشه جزء سبک مقداری جزء سنگین و جزء سنگین نیز دارای مقداری از جزء سبک است.
در تقطير يك ماده خالص چنانچه مايع زياده از حد گرم نشود درجه حرارتي كه در گرماسنج ديده مي شود يعني درجه حرارت دهانه ي خروجي با درجه حرارت مايع جوشان در ظرف تقطير يعني درجه حرارت ظرف يكسان است. درجه حرارت دهانه خروجي كه به اين ترتيب به نقطه جوش مايع مربوط مي شود در طول تقطير ثابت مي ماند.
هرگاه در مايعي که تقطير مي شود ناخالصي غير فراري موجود باشد درجه حرارت دهانه خروجي همان درجه حرارت مايع خالص است زيرا ماده اي كه بر روي حباب گرماسنج متراكم مي شود به ناخالصي آلوده نيست. ولي درجه حرارت ظرف به علت كاهش فشار بخار محلول بالا مي ررود. در جريان تقطير درجه حرارت ظرف نيز افزايش مي يابد.زيرا كه غلظت ناخالصي با تقطير جز فرار به تدريج زياد مي شود و فشار بخار مايع بيشتر پايين مي ايد ، با وجود اين درجه حرارت دهانه خروجي مانند مايع خالص ثابت مي ماند. رابطه كمي موجود بين فشار بخار وتركيب مخلوط همگن مايع (محلول) به قانون رائول معروف است.
تقطیر تبخیر آنی (ناگهانی):
وقتی محلول چند جزئی مانند نفت خام را حرارت میدهیم ، اجزای تشکیل دهنده آن بترتیب که سبکتر هستند، زودتر بخار میشود. برعکس وقتی بخواهیم این بخارها را سرد و دوباره تبدیل به مایع کنیم، هر کدام که سبکتر باشد دیرتر مایع میگردد. با توجه به این خاصیت ، میتوانیم نفت خام را به روش دیگری که به آن "تقطیر آنی" گویند، تقطیر نماییم. در این روش ، نفت خام را چنان حرارت میدهیم که ناگهان همه اجزای آن تبدیل به بخار گردد و سپس آنها را سرد میکنیم تا مایع شود. در اینجا ، بخارها به ترتیب سنگینی ، مایع میشوند یعنی هرچه سنگینتر باشند، زودتر مایع میگردند و بدین گونه ، اجزای نفت خام را با ترتیب مایع شدن از هم جدا میکنیم.
تقطیر در خلا :
با توجه به اینکه نقطه جوش مواد سنگین نفتی نسبتا بالاست و نیاز به دما و انرژی بیشتری دارد، و از طرف دیگر ، مقاومت این مواد در مقابل حرارت بالا کمتر میباشد و زودتر تجزیه میگردند، لذا برای جداکردن آنها از خلا نسبی استفاده میشود. در این صورت مواد دمای پایینتر از نقطه جوش معمولی خود به جوش میآیند. در نتیجه ، تقطیر در خلا ، دو فایده دارد: اول این که به انرژی و دمای کمتر نیاز است، دوم اینکه مولکولها تجزیه نمیشوند. امروزه در بیشتر موارد در عمل تقطیر ، از خلا استفاده میشود. یعنی این که: هم تقطیر جزء به جزء و هم تقطیر آنی را در خلا انجام میدهند.
تقطیر به کمک بخار آب :
یکی دیگر از طرق تقطیر آن است که بخار آب را در دستگاه تقطیر وارد میکنند در این صورت بی آنکه خلاءای ایجاد گردد، اجزای نفت خام در درجه حرارت کمتری تبخیر میشوند. این مورد معمولا در زمانی انجام میشود که در نقطه جوش آب ، فشار بخار اجزای جدا شونده بالا باشد تا به همراه بخار آب از مخلوط جدا گردند.
غالبابه كمك تقطير با بخار آب مي توان تركيبات آلي فراري را كه با آب مخلوط نمي شوند يا تقريبا با آن غير قابل اختلاط هستند تفكيك و تخليص كرد. در اين روش مخلوط آب وجسم آلي با هم تقطير مي شوند.عمل تقطير يك مخلوط غير قابل امتزاج در صورتي كه يكي از اجزا آب باشد تقطير با بخار آب ناميده مي شود.
تقطیر آزئوتروپی :
از این روش تقطیر معمولا در مواردی که نقطه جوش اجزاء مخلوط بهم نزدیک باشند استفاده میشود، جداسازی مخلوط اولیه ، با افزایش یک حلال خاص که با یکی از اجزای کلیدی ، آزئوتوپ تشکیل میدهد امکانپذیر است. آزئوتروپ محصول تقطیر یا ته مانده را از ستون تشکیل میدهد و بعد حلال و جزء کلیدی را از هم جدا میکند. اغلب ، ماده افزوده شده آزئوتروپی با نقطه جوش پایین تشکیل میدهد که به آن شکننده آزئوتروپ میگویند. آزئوتروپ اغلب شامل اجزای خوراک است، اما نسبت اجزای کلیدی به سایر اجزای خوراک خیلی متفاوت بوده و بیشتر است.
مثالی از تقطیر آزئوتروپی استفاده از بنزن برای جداسازی کامل اتانول از آب است، که آزئوتروپی با نقطه جوش پایین با 6/95% وزنی الکل را تشکیل میدهد. مخلوط آب- الکل با 95% وزنی الکل به ستون تقطیر آزئوتروپی افزوده میشود و جریان جریان غنی از بنزن از قسمت فوقانی وارد میشود. محصول ته مانده الکل تقریبا خالص است وبخار بالایی یک آزئوتروپی سهگانه است. این بخار مایع شده، به دو فاز تقسیم میشود. لایه آلی برگشت داده شده، لایه آلی به ستون بازیافت بنزن فرستاده میشود. همه بنزن و مقدار الکل در بخار بالایی گرفته شده، به ستون اول روانه میشوند. جریان انتهایی در ستون سوم تقطیر میشود تا آب خالص و مقداری آزئوتروپ دوگانه از آن بدست آید.
تقطیر استخراجی :
جداسازی اجزای با نقطه جوش تقریبا یکسان از طریق تقطیر ساده مشکل است حتی اگر مخلوط ایده آل باشد و به دلیل تشکیل آزئوتروپ ، جداسازی کامل آنها غیر ممکن است برای چنین سیستم هایی با افزایش یک جزء سوم به مخلوط که باعث تغییر فراریت نسبی ترکیبات اولیه میشود، جداسازی ممکن میشود. جزء افزوده شده باید مایعی با نقطه جوش بالا باشد، قابلیت حل شدن در هر دو جزء کلیدی را داشته باشد و از لحاظ شیمیایی به یکی از آنها شبیه باشد. جزء کلیدی که به حلال بیشتر شبیه است ضریب فعالیت پایین تری از جزء دیگر محلول دارد، در نتیجه جداسازی بهبود می یابد این فرآیند ، تقطیر استخراجی نام دارد.
مثالی از تقطیر استخراجی، استفاده از فور فورال در جداسازی بوتادیان و بوتن است، فورفورال که حلالی به شدت قطبی است، فعالیت بوتادی ان را بیش تر از بوتن و بوتان کم میکند و غلظت بوتادی ان وفورفورال وارد قسمت فوقانی ستون تقطیر استخراجی شود، با انجام تقطیر بوتادی ان از فورفورال جدا میشود.
تقطیر جزء به جزء :
اجزای سازنده محلول شامل دو یا چند فرار را که از قانون رائول پیروی میکنند، میتوان با فرایند تقطیر جزء به جزء از هم جدا کرد. طبق قانون رائول ، فشار بخار محلول برابر با مجموع اجزای سازنده آن است و سهم هر جزء برابر با حاصلضرب کسر مولی آن جزء به جزء در فشار بخار آن در حالت خاص است. در تقطیر محلولی از B و A ، غلظت A در بخاری که خارج شده و مایع میشود، بیش از غلظت آن در مایع باقی مانده است. با ادامه عمل تقطیر ، ترکیب درصد اجزا در بخار و مایع دائما تغییر میکند و این در هر نقطه عمومیت دارد. با جمع آوری مایعی که از سردشدن بخار حاصل میشود و از تقطیر مجدد آن و با تکراری پی در پی این عمل ، سرانجام میتوان اجزای سازنده مخلوط اصلی را به صورتی واقعا خالص بدست آورد.
از نظر سهولت در اينجا فقط محلولهاي ايده آل دو تايي را كه محتوي دو جز فرار RوS باشند در نظر مي گيريم. محلول ايده ال به محلولي اطلاق مي شود كه در آن اثرات بين مولكولهاي متجانس مشابه با اثرات بين مولكولهاي غير متجانس باشد.گرچه فقط محلولهاي ايده ال به طور كامل از قانون رائول پيروي مي كنند ولي بسياري از محلولهاي آلي به محلولهلي ايده آل نزديك هستند.
تقطير جزبه جز محلول هاي غير ايده ال
گرچه بيشتر مخلوط هاي يكنواخت مايع به صورت محلولهاي ايده ال عمل مي كنند ولي نمونه هاي بسياري وجود دارد كه نحوه عمل آنها ايده آل نيست.در اين محلولها مولكولهاي غير متجانس در مجاورت يكديگر به طور يكسان عمل نمي كنند انحراف حاصل از قانون رائول به دو روش انجام ميگيرد:
بعضي از محلولها فشار بخار بيشتري از فشار بخار پيش بيني شده ظاهر مي سازندوگفته مي شود كه انحراف مثبت دارند. بعضي ديگر فشار بخار كمتري از فشار پيش بيني شده آشكار مي كنندومي گويند كه انحراف منفي نشان مي دهند.
در انحراف مثبت نيروي جاذبه بين مولكولهاي مختلف دو جز سازنده ضعيف تر از نيروي جاذبه بين مولكولهاي مشابه يك جز است و در نتيجه در حدود تركيب درصد معيني فشار بخار مشترك دو جز بزرگتر از فشار بخار جز خالصي مي شود كه فرارتر است. بنابراين مخلوط هايي كه تركيب درصد آنها در اين حدود باشد درجه جوش كمتري از هر يك از دو جز خالص دارند.مخلوطي كه در اين حدود حداقل درجه جوشش را دارد بايد به صورت جز سوم در نظر گرفته شود.اين مخلوط نقطه جوش ثابتي دارد زيرا تركيب درصد بخاري كه در تعادل با مايع است با تركيب درصد خود مايع برابر است.چنين مخلوطي را آزئوتروپ يا مخلوط آزئوتروپ با جوشش مينيمم مي نامند. از تقطير جز به جز اين مخلوط ها هر دو جز به حالت خالص به دست نمي آيد بلكه جزيي كه تركيب درصد آن از تركيب درصد آزئوتروپ بيشتر باشد توليد مي شود.
در انحراف منفي از قانون رائول نيروي جاذبه بين مولكولهاي مختلف دو جز قويتر از نيروي جاذبه بين مولكولهاي مشابه يك جز است ودر نتيجه تركيب درصد معيني فشار بخار مشترك دو جز كمتر از فشار بخار جز خالص مي شود كه فرارتر است.بنابراين مخلوط هايي كه تركيب درصد آنها در اين حدود باشد حتي نسبت به جز خالصي كه نقطه جوش بيشتري دارد در درجه حرارت بالاتري مي جوشند.در اينجا تركيب درصد به خصوصي وجود دارد كه به آزئو تروپ با جوشش ماكسيمم مربوط مي شود. تقطير جز به جز محلولهايي كه تركيب درصدي غير از تركيب درصد آزئوتروپ دارندباعث خروج جزيي مخلوط مي شود كه تركيب درصد آن از آزئوتروپ بيشتر باشد.
ستونهاي تقطيرجز به جز:
اين ستونها انواع متعددي دارد ولي در تمام آنها خصلت هاي مشابهي وجود دارد. اين ستونها مسير عمودي را به وجود مي آورند كه بايد بخار در انتقال از ظرف تقطير به مبرد از آن بگذرد. اين مسير به مقدار قابل ملاحظه اي از مسير دستگاه تقطير ساده طويل تر است. هنگام انتقال بخار از ظرف تقطير به بالاي ستون مقداري از بخار متراكم مي شود.چنان چه قسمت پايين اين ستون نسبت به قسمت بالاي آن در درجه حرارت بيشتري نگه داري شود مايع متراكم شده و در حالي كه به پايين ستون مي ريزد دوباره به طور جزيي تبخير مي شود .بخار متراكم نشده همراه بخاري كه از تبخير مجدد مايع متراكم شدهحاصل مي شود در داخل ستون بالاتر مي رود واز يك سري تراكم وتبخير مي گذرد. اين اعمال باعث تقطير مجدد مايع مي شود و به طوريكه در هر يك از مراحل فاز بخاري كه به وجود مي آيد نسبت به جز فرارتر غني تر مي شود.ماده متراكم شده اي كه به پايين ستون مي ريزددر مقايسه با بخاري كه با آن در تماس است در هر يك از مراحل نسبت جزيي كه فراريت كمتري دارد غني تر مي شود.
در شرايط ايده ال بين فازهاي مايع و بخار در سراسر ستون تعادل برقرار مي شود و فاز بخار بالايي تقريبا به طور كامل از جز فرارتر تشكيل مي شود و فاز مايع پاييني نسبت به جزيي كه فراريت كمتري دارد غني تر مي شود.
مهم ترين شرايطي كه براي ايجاد اين حالت لازم است عبارتند از :
تماس كامل و مداوم بين فازهاي بخار و مايع در ستون
حفظ افت مناسبي از درجه حرارت در طول ستون
طول كافي ستون
اختلاف كافي در نقاط جوش اجزاي مخلوط مايع
چنانچه دو شرط اول كاملا مراعات شود مي توان با يك ستون طويل تركيباتي كه اختلاف كمي در نقطه ي جوش دارند به طور رضايت بخش از هم جدا كرد زيرا طول ستون مورد لزوم و اختلاف نقاط جوش اجزا با هم نسبت عكس دارند. معمولترين راه ايجاد تماس لازم در بين فازهاي مايع آن است كه ستون با مقداري ماده بي اثر مانند شيشه يا سراميك يا تكه هاي فلزي به اشكال مختلف كه سطح تماس وسيعي را فراهم مي كند پر شود. يكي از راه هاي بسيار موثر ايجاد اين تماس بين مايع و بخار آن است كه نوار چرخاني از فلز يا تفلون كه با سرعت زيادي در داخل ستون بچرخد به كار رود.
اين عمل نسبت به ستون هاي پر شده اي كه قدرت مشابهي دارند اين مزيت را دارد كه ماده كمي را در داخل ستون نگاه مي دارد (منظور از اين نگه داري مقدار مايع و بخاري است كه براي حفظ شرايط تعادل در داخل ستون لازم است.)
تقطیر تبخیر ناگهانی
در این نوع تقطیر ، مخلوطی از مواد نفتی که قبلا در مبدلهای حرارتی و یا کوره گرم شدهاند، بطور مداوم به ظرف تقطیر وارد میشوند و تحت شرایط ثابت ، مقداری از آنها به صورت ناگهانی تبخیر میشوند. بخارات حاصله بعد از میعان و مایع باقیمانده در پایین برج بعد از سرد شدن به صورت محصولات تقطیر جمع آوری میشوند. در این نوع تقطیر ، خلوص محصولات چندان زیاد نیست.
تقطیر با مایع برگشتی ( تقطیر همراه با تصفیه )
در این روش تقطیر ، قسمتی از بخارات حاصله در بالای برج ، بعد از میعان به صورت محصول خارج شده و قسمت زیادی به داخل برج برگردانده میشود. این مایع به مایع برگشتی موسوم است. مایع برگشتی با بخارات در حال صعود در تماس قرار داده میشود تا انتقال ماده و انتقال حرارت ، صورت گیرد. از آنجا که مایعات در داخل برج در نقطه جوش خود هستند، لذا در هر تماس مقداری از بخار، تبدیل به مایع و قسمتی از مایع نیز تبدیل به بخار میشود.
نتیجه نهایی مجوعه این تماسها ، بخاری اشباع از هیدروکربنهای با نقطه جوش کم و مایعی اشباع از مواد نفتی با نقطه جوش زیاد میباشد. در تقطیر با مایع برگشتی با استفاده از تماس بخار و مایع ، میتوان محصولات مورد نیاز را با هر درجه خلوص تولید کرد، مشروط بر اینکه به مقدار کافی مایع برگشتی و سینی در برج موجود باشد. بوسیله مایع برگشتی یا تعداد سینیهای داخل برج میتوانیم درجه خلوص را تغییر دهیم. لازم به توضیح است که ازدیاد مقدار مایع برگشتی باعث افزایش میزان سوخت خواهد شد. چون تمام مایع برگشتی باید دوباره به صورت بخار تبدیل شود.
امروزه به علت گرانی سوخت ، سعی میشود برای بدست آوردن خلوص بیشتر محصولات ، به جای ازدیاد مایع برگشتی از سینیهای بیشتری در برجهای تقطیر استفاده شود. زیاد شدن مایع برگشتی موجب زیاد شدن انرژی میشود. برای همین ، تعداد سینیها را افزایش میدهند. در ابتدا مایع برگشتی را صد درصد انتخاب کرده و بعد مرتبا این درصد را کم میکنند و به صورت محصول خارج میکنند تا به این ترتیب دستگاه تنظیم شود.
انواع مایع برگشتی
• مایع برگشتی سرد:
این نوع مایع برگشتی با درجه حرارتی کمتر از دمای بالای برج تقطیر برگردانده میشود. مقدار گرمای گرفته شده ، برابر با مجموع گرمای نهان و گرمای مخصوص مورد نیاز برای رساندن دمای مایع به دمای بالای برج است.
• مایع برگشتی گرم:
مایع برگشتی گرم با درجه حرارتی برابر با دمای بخارات خروجی برج مورد استفاده قرار میگیرد.
• مایع برگشتی داخلی:
مجموع تمام مایعهای برگشتی داخل برج را که از سینیهای بالا تا پایین در حرکت است، مایع برگشتی داخلی گویند. مایع برگشتی داخلی و گرم فقط قادر به جذب گرمای نهان میباشد. چون اصولا طبق تعریف اختلاف دمایی بین بخارات و مایعات در حال تماس وجود ندارد.
• مایع برگشت دورانی:
این نوع مایع برگشتی ، تبخیر نمیشود. بلکه فقط گرمای مخصوص معادل با اختلاف دمای حاصل از دوران خود را از برج خارج میکند. این مایع برگشتی با دمای زیاد از برج خارج شده و بعد از سرد شدن با درجه حرارتی کمتر به برج برمیگردد. معمولا این نوع مایع برگشتی درقسمتهای میانی یا درونی برج بکار گرفته میشود و مایع برگشتی جانبی هم خوانده میشود. اثر عمده این روش ، تقلیل حجم بخارات موجود در برج است.
نسبت مایع برگشتی
نسبت حجم مایع برگشتی به داخلی و محصول بالایی برج را نسبت مایع برگشتی گویند. از آنجا که محاسبه مایع برگشتی داخلی نیاز به محاسبات دقیق دارد، لذا در پالایشگاهها ، عملا نسبت مایع برگشتی بالای برج به محصول بالایی را به عنوان نسبت مایع برگشتی بکار میبرند.
تقطیر نوبتی
این نوع تقطیرها در قدیم بسیار متداول بوده، ولی امروزه بعلت نیاز نیروی انسانی و ضرورت ظرفیت زیاد ، این روش کمتر مورد توجه قرار میگیرد. امروزه تقطیر نوبتی ، صرفا در صنایع دارویی و رنگ و مواد آرایشی و موارد مشابه بکار برده میشود و در صنایع پالایش نفت در موارد محدودی مورد استفاده قرار میگیرد. بنابراین در موارد زیر ، تقطیر نوبتی از نظر اقتصادی قابل توجه میباشد.
• تقطیر در مقیاس کم
• ضرورت تغییرات زیاد در شرایط خوراک و محصولات مورد نیاز
• استفاده نامنظم از دستگاه
• تفکیک چند محصولی
• عملیات تولید متوالی با فرآیندهای مختلف
تقطیر مداوم
امروزه بعلت اقتصادی بودن مداوم در تمام عملیات پالایش نفت از این روش استفاده میشود. در تقطیر مداوم برای یک نوع خوراک مشخص و برشهای تعیین شده شرایط عملیاتی ثابت بکار گرفته میشود. بعلت ثابت بودن شرایط عملیاتی در مقایسه با تقطیر نوبتی به مراقبت و نیروی انسانی کمتری احتیاج است. با استفاده از تقطیر مداوم در پالایشگاهها مواد زیر تولید میشود:
گاز اتان و متان بعنوان سوخت پالایشگاه ، گاز پروپان و بوتان بعنوان گاز مایع و خوراک واحدهای پتروشیمی ، بنزین موتور و نفتهای سنگین بعنوان خوراک واحدهای تبدیل کاتالیستی برای تهیه بنزین با درجه آروماتیسیته بالاتر ، حلالها ، نفت سفید ، سوخت جت سبک و سنگین ، نفت گاز ، خوراک واحدهای هیدروکراکینگ و واحدهای روغن سازی ، نفت کوره و انواع آسفالتها.
برج تقطیر
بطور کلی برج تقطیر شامل 4 قسمت اصلی می باشد :
.1برج (Tower)
.2سیستم جوشاننده (Reboiler)
.3سیستم چگالنده (Condensor)
.4تجهیزات جانبی شامل: انواع سیستمهای کنترل کننده، مبدلهای حرارتی میانی، پمپها و مخازن جمع آوری محصول.
بطور کلی برجهایی که در صنعت جهت انجام عمل تقطیر مورد استفاده قرار می گیرند، به دو دسته اساسی تقسیم می شوند:
- برجهای سینی دا ر Tray Towers)
- برجهای پرشده (Packed Towers)
طرز کار یک برج سینی دار
بطور کلی فرآیندی که در یک برج سینی دار اتفاق می افتد، عمل جداسازی مواد است. همانطور که ذکر شد فرآیند مذکور به طور مستقیم یا عیرمستقیم انجام می پذیرد.
در فرآیند تقطیر منبع حرارتی (Reboiler)، حرارت لازم را جهت انجام عمل تقطیر و تفکیک مواد سازنده یک محلول تأمین میکند. بخار بالارونده از برج با مایعی که از بالای برج به سمت پایین حرکت می کند، بر روی سینی ها تماس مستقیم پیدا می کنند. این تماس باعث ازدیاد دمای مایع روی سینی شده و نهایتا باعث نزدیک شدن دمای مایع به دمای حباب می گردد. با رسیدن مایع به دمای حباب به تدریج اولین ذرات بخار حاصل می شود که این بخارات غنی از ماده فرار (ماده ای که از نقطه جوش کمتری و یا فشار بالاتری برخوردار است) می باشد.از طرفی دیگر در فاز بخار موادی که از نقطه جوش کمتری برخوردار هستند، تحت عمل میعان قرار گرفته و بصورت فاز مایع به سمت پایین برج حرکت می کند. مهمترین عملکرد یک برج ایجاد سطح تماس مناسب بین فازهای بخار و مایع است. هر چه سطح تماس افزایش یابد عمل تفکیک با راندمان بالاتری صورت میگیرد. البته رژیم جریان مایع بر روی سینی نیز از جمله عوامل مهم بر عملکرد یک برج تفکیک می باشد.
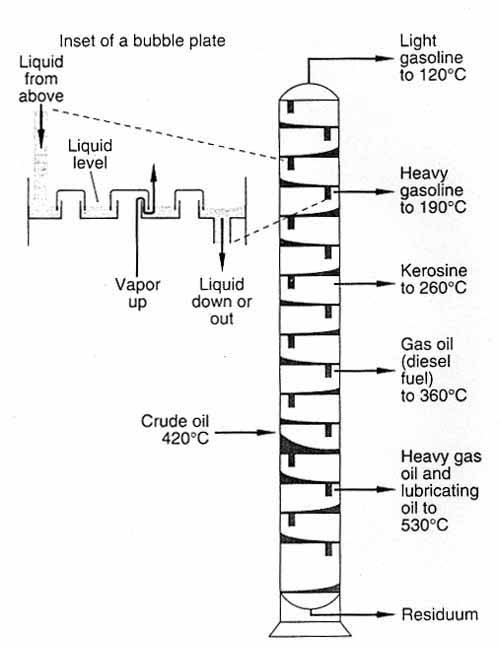
عبارات و اصطلاحات مربوط به فر آیند تقطیر :
(Feed) خوراک
مخلوط ورودی به داخل برج که ممکن است مایع، گاز و یا مخلوطی از مایع و گاز باشد، خوراک (Feed) نام دارد. معمولا محل خوراک در نقطه مشخصی از برج است که از قبل تعیین می شود. در برجهای سینی دار محل ورودی خوراک را سینی خوراک یا (Feed Tray) می نامند. از جمله مشخصات مهم سینی خوراک این است که از نقطه نظر درجه حرارت و ترکیب نسبی (کسر مولی) ، جزء مورد نظر با خوراک ورودی مطابقت داشته باشد. البته محل خوراک ورودی به حالت فیزیکی خوراک نیز بستگی دارد. معمولا اگر خوراک بصورت مایع باشد، همراه با مایعی که از سینی بالایی سرازیر می شود به درون سینی خوراک وارد می گردد. اگر خوراک بصورت بخار باشد معمولا آن را از زیر سینی خوراک وارد می کنند و اگر خوراک بصورت مخلوطی از مایع و بخار باشد، بهتر است که ابتدا فاز مایع و بخار را از هم جدا نموده و سپس به طریقی که گفته شد خوراک را وارد برج نمایند. ولی عملا به منظور صرفه جویی از هزینه های مربوط به تفکیک دو فاز بخار و مایع، عمل جداسازی به ندرت صورت می گیرد.
(Overhead Product) محصول بالاسری
آنچه از بالی برج به عنوان خروجی از آن دریافت می شود محصول بالاسری نامیده می شود که معمولا غنی از جزئی که از نقطه جوش کمتری برخوردار است می باشد.
(Bottom Product) محصول ته مانده
ماده ای که از پایین برج خارج می شود ته مانده یا محصول انتهایی (Bottom) نام دارد و معمولا غنی از جزء یا اجزائ سنگین تر (که از نقطه جوش بالاتری برخوردار می باشند) خواهد بود.
(Reflux Ratio) نسبت برگشت یا پس ریز
نسبت مقدار مایع برگشتی به برج بر حسب مول یا وزن به مایع یا بخاری که به عنوان محصول از سیستم خارج می شود را نسبت برگشتی می گویند و آن را با حرف R نشان می دهند.
نسبت برگشتی و اثرات آن بر شرایط کارکرد برج
با افزایش نسبت مایع برگشتی تعداد سینی های مورد نیاز جهت تفکیک (طول برج) کاهش می یابد، اما در مقابل آن بار حرارتی کندانسور و جوش آور و مقادیر بخار و مایع در طول برج افزایش می یابد. در این صورت نه تنها لازم است سطوح گرمایی مورد نیاز به آنها اضافه شود، بلکه به دلیل افزایش میزلن جریان مایع و بخار سطح مقطع برج نیز افزایش می یابد.
هنگامی که مقدار R زیاد باشد تعداد مراحل و طول برج به کمترین مقدار خود می رسد و تمام محصول بالاسری به عنوان مایع برگشتی وارد برج می شود و این حالت را برگشت کامل یا (Total Reflux) می نامند.
در شرایطی که R در کمترین مقدار خود باشد طول برج و تعداد مراحل در بیشترین مقدار خود خواهد بود و عمل تفکیک به شکل کاملی انجام نخواهد شد. مقدار عملی R معمولا بین حالت برگشت کامل و حداقل میزان R است. در بیشتر موارد مقدار مایع برگشتی بر روی درجه حرارت برج نیز تأثیر می گذارد. معمولا در یک برج تقطیر دمای انتهای آن به مراتب بیشتر از دمای پایین آن است و این اختلاف دما در طول برج وجود خواهد داشت. میزان جریان برگشتی به عنوان یک عامل کنترلی بر روی درجه حرارت سیستم خواهد بود.
(Reboiler) جوش آور
جوش آورها که معمولا در قسمت های انتهای برج و کنارآن قرار داده می شود، وظیفه تأمین حرارت یا انرژی لازم را برای انجام عمل تقطیر به عهده دارند.
معمولا جوش آورها به عنوان یک مرحله تعادلی در عمل تقطیر و به عنوان یک سینی در برجهای سینی دار در نظر گرفته می شوند.
(Condenser) چگالنده
نقش چگالنده در واقع تبدیل بخارات حاصل از عمل حرارت دهی به مخلوط، به مایع می باشد. این امر در اصطلاح میعان یا چگالش نامیده می شود و دستگاهی که در آن عمل مذکور انجام می شود چگالنده نام دارد. به طور کلی چگالنده ها به دو دسته اساسی تقسیم می شوند:
-چگالنده های کامل (Total Condenser)
-چگالنده های جزئی (Partial Condenser)
در صورتیکه تمام بخار بالای برج به مایع تبدیل شود و بخشی ازآن وارد برج شده و بخش دیگر وارد مخزن جمع آوری محصول گردد عمل میعان کامل (Total Condensation) انجام شده است. اما اگر بخشی از بخارات حاصل مایع شده و بخش دیگر به صورت بخار از کندانسور خارج شود به آن یک کندانسور جزئی گفته می شود.
● كتاب شيمي آلي تجربي نوين / جلد اول وجلد دوم / نويسندگان: رابرتس- گيلبرت-ردوالد- وينگرو / مترجم: هوشنگ پير الهي
● كتاب شيمي عملي و آلي / مولفين: آقايان جليليان- وارسته مرادي- احمدي گلسفيدي
حجم فایل : 16کیلو بایت | فرمت فایل ها :doc. | زبان : فارسی
لینک دانلود | پسورد فایل : kimiagari.ir
سایت رشته صنایع شیمیایی...
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 3245 تاريخ : سه شنبه 29 آذر 1390 ساعت: 13:56
با سلام این گزارش کار به درخواست خانم صالحی قرار داده شده است :
امید وارم که از این گزارش کار بهره ببرید .
روش های کمپلکسومتری یا پیچیده سنجی
تیتراسیونهای کمپلکسومتری: تعیین غلظت یک گونه(عمدتاً کاتیون فلزی) بتوسط تشکیل کمپلکس با یک لیگاند ....
با سلام این گزارش کار به درخواست خانم صالحی قرار داده شده است :
امید وارم که از این گزارش کار بهره ببرید .
گزارش كار آزمايشگاه شيمي تجزيه
اندازه گيري غلظت Ca2+ و Mg2+ با استفاده از EDTA
روش های کمپلکسومتری یا پیچیده سنجی
تیتراسیونهای کمپلکسومتری: تعیین غلظت یک گونه(عمدتاً کاتیون فلزی) بتوسط تشکیل کمپلکس با یک لیگاند
انواع لیگاندها:
1- لیگاندتک دندانه ای:
گونة دهنده زوج الکترون که معمولاً یک محل برای کوئوردیناسیون ویا تشکیل کمپلکس با کاتیون دارد.
2- لیگاند چند دندانه ای:
گونة دهنده زوج الکترون که چندین محل برای کوئوردیناسیون ویا تشکیل کمپلکس با کاتیون دارد. Ü عوامل کی لیت ساز
کی لیت: یک کی لیت هنگامی تشکیل می شود که یک یون فلزی با دو (یا بیشتر) گروه دهندة الکترون تک لیگاندی (چند دندانه ای) کوئوردینه شود.
EDTA
بهترین لیگاند چند دندانه ای برای تیتراسیونهای کمپلکسومتری اتیلن ديآمين تترا استيك اسيد (EDTA) می باشد.
EDTA یک ليگاند شش دندانهاي است که صرف نظر از بار کاتیونها با آنها به نسبت 1:1 تشکیل کمپلکس می دهد.
فرم های مختلف EDTA بر حسب pH محیط
EDTA یک اسید چهار پروتونی است که بسته به pH محیط به فرم های مختلف تبدیل می شود:
CT: غلظتEDTA كمپلكس نشده است.
:a مقدار نسبي هر گونه به جزء مولي هر گونه
واكنش انجام گرفته در محيط اسيدي ملايم:
M n+ + H2Y 2- MY (n-4)+ + 2H+
واكنش انجام گرفته در محيط خنثي تا بازي ملايم:
M n+ + HY 3- MY (n-4)+ + H+
وسعت تشكيل كمپلكس باEDTA بهpH محيط بستگي دارد.
- براي تيتراسيون كاتيونهايي از قبيلMg2+ و Ca2+ كه كمپلكس هاي نسبتاً ضعيف ايجاد ميكنند به محيط قليايي نياز است.
- اگر كاتيون كمپلكس قويتر تشكيل دهد در محيط اسيدي نيز ميتوان تيتر نمود.
وابستگی تشکیل کمپلکس EDTA – کاتیون به pH
تيتراسيونهاي EDTA به علت وابستگي به pH در محلولهاي با pH ثابت (از پيش تعيين شده) انجام می شوند.
براي نگهداشتن يون فلزي به شكل حل شده (غیر رسوب) در داخل محلول (به خصوص در اوايل تيتراسيون) يك عامل كمپلكس كننده كمكي (مانند NH3) به محلول اضافه ميكنند. درنتيجه ممکن است کاتیون به فرم های مختلف (علاوه بر Mn+) در محلول وجود داشته باشد. چونpH بر روي تشكيل كمپلكس تأثير دارد. تيتراسيونهايEDTA بهpH وابستهاند پس درpH (بافردار شده) اجراء ميگردد.
از روي k/MY ميتوان غلظتهاي تعادلي يون فلزي و كمپلكس را روي هر نقطه از منحني تيتراسيون را محاسبه كرد.
منحنی های کمپلکسومتری
رسم pM (منفی لگاریتم غلظت کاتیون) بر حسب حجم EDTA افزوده شدهÜ تعیین نقطه عطف نمودار Ü تعیین غلظت دقیق کاتیون مورد نظر
تعیین نقطه پایان در تیتراسیونهای کمپلکسومتری
از شناساگرهایی استفاده می کنند که با کاتیون تشکیل کمپلکسهایی را می دهد که رنگ آن متفاوت از رنگ شناساگر به فرم آزاد است.
شناساگر کمپلکسومتری خودش یک لیگاند است که با کاتیون مورد نظر تشکیل کمپلکس می دهد و دارای حداقل دو فرم آزاد و کمپلکس شده با فلز است.
اگر در طول تيتراسيون يك كمپلكس رنگي تشكيل شود، مي توان از اسپكتروفتومتري و ساير روشهاي دستگاهي براي تعيين نقطه پايان استفاده نمود. معرفهاي شيميايي نيز براي تعيين نقطه پايان تيتراسيون به كار مي روند. بعضي از ليگاند ها را مي توان به عنوان معرف در كمپلكسومتري به كار برد. ليگاند معرف با يون فلزي تشكيل يك كمپلكس رنگي مي دهد. مثل تيوسيانات با يون فريك.
البته كمپلكس يون فلز- معرف نبايستي پايدار تر از كمپلكس بين يون فلزي و عامل كمپلكس كننده كه به صورت تيترانت با تيتراند به كار مي رود، باشد. ليگاند معرف با يون فلزي محلول در ظرف تيتراسيون به صورت كمپلكس رنگي در مي آيد. در صورتي كه يون فلزي در تيتراند وجود نداشته باشد، كمپلكس يون فلزي- معرف رنگي تشكيل نمي شود.
تيوسيانات معرفي از اين نوع مي باشد كه در تيتراسيون آهن توسط EDTA به كار مي رود. قبل از نقطه پايان كمپلكس قرمز تيوسيانات آهن (III) در محلول وجود دارد، در نقطه پايان رنگ ناپديد مي شود. اگر EDTA با آهن (III) تيتر شود، تغيير رنگ معكوس مي گردد. معرفي كه با يون فلزي تشكيل كمپلكسي را مي دهد كه در تيتراسيون شركت مي نمايد، معرف متالوكروميك گويند. بسياري از معرف هاي متالوكروميك به صورت معرفهاي اسيد باز عمل مي كنند. از اين لحاظ pH محلول بايستي كنترل شود. زيرا اين معرف ها علاوه بر يونهاي H+ نيز وارد واكنش مي شوند و همان تغيير رنگ را مي دهند و بايستي در محدوده اي از pH به كار روند كه در رقابت با يونهاي H+ نباشد.
شناساگر اريوكروم بلاكتي
از مهمترین و پر کاربردترین شناساگرهای کمپلکسومتری با لیگاند EDTA است.
بسته به pH محیط یکی از فرم های شناساگر غالب است.
کمپلکس شدن شناساگر اریوکروم بلاک تی با کاتیون درpH بالاتر از 7
عمدتاً کمپلکسهای شناساگر اريوكروم بلاكتي با کاتیونها در محیطهای قلیایی ملایم به رنگ قرمز می باشد که متفاوت از رنگ شناساگر آزاد در این محیط است.
ملاک استفاده از شناساگرهای کمپلکسومتری
برای تشخیص دقیق نقطه پایان باید
1- kf(Min) < 1/10 ´ kf(MY)
2- در غير اينصورت اگر kf(Min) <1/10´kf(MY)، نقطه پاياني زودرس داريم (يك مقدار فلز توسط شناساگر مصرف ميگردد).
مانند مورد تیتر Ca2+ با EDTA
راه حل: استفاده از یک شناساگر دیگر
3- از طرف ديگر اگر kf(MIn) << 1/10 ´ kf(MY) Ü نقطه پاياني ديررس داريم
انواع روشهاي تيتراسيون با EDTA
1ـ مستقيم: باید راهي براي تعيين نقطه پاياني وجود داشته باشد وMn+ با EDTA سريعاً تشکیل كمپلكس دهد.
2ـ معكوس: كاتيونهايي كه باEDTA تشكيل كمپلكس بسيار پايداري ميدهند. ولی شناساگر مناسبی براي تعیین نقطه پايان وجود ندارد.
(مازاد)Mn+ + Y4- D MYn-4 + Y4
EDTA (مازاد) با Ca2+ یا Mg2+ در حضور شناساگر اریوکروم بلاک تیتر می گردد.
3- تيتراسيونهاي جانشيني: وقتی که شناساگر مناسبي براي يون فلزي وجود نداشته باشد.
MgY2- + Mn+ g MYn-4 + Mg2+
Mg2+ آزاد شده توسط EDTA تيتر ميگردد.
شرط انجام تیتراسیون: kf(MY) >> kf(MgY)
4- تيتراسيونهاي قلياسنجي:
Mn+ + H2Y2- (excess) D MYn-4 + 2H+
يون هيدروژن آزاد شده را توسط قلیا یا باز تيتر ميكنند.
گراوی متری:
تجزیه وزنی بر مبنای اندازه گیری وزن یک ماده با ترکیب معلوم که ارتباط شیمیایی با ماده مورد تجزیه وارد استوار است وممکن است به روش های زیر صورت گیرد:
1- طریقه رسوب دادن: توسط اضافه کردن یک معرف جزء مورد نظر را از بقیه اجزا به صورت رسوبی که ترکیب شیمیایی آن معلوم است جدا می کنند.
2- روش های تبخیری: اجسامی که دارای اجزای فراری چون H2O,CO2 هستند، حرارت داده و گاز حاصله داده را به وسیله جاذب جذب می کنند.
3- روش الکترولیتیک: توسط عبور دادن جریان الکتریکی در کاتد رسوب مي دهند.
شرح آزمايش:
ابتدا 20 ml از محلول Ca2+ و Mg2+ را برداشته، 2.5 ml محلول بافر آمونياك و آمونيوم كلريد، و 8 قطره معرف اريو كروم بلاك تي به آن اضافه كرده تا قرمز شود. سپس محلول را با EDTA تيتر كرده تا به رنگ آبي درآيد. حجم V1 را مي خوانيم(V1 = 39.1 ml) .
در مرحله بعد نيز 20 ml از محلول را برداشته، 2 ml سود 5 نرمال و 4 قطره معرف كالكون اضافه مي كنيم. محلول صورتي مي شود. آن را با EDTA تيتر مي كنيم تا آبي شود. حجم V2 را مي خوانيم(V2 = 18.2 ml) .
با روابط زير، غلظت Ca2+ وMg2+ را حساب مي كنيم:
N1.V1 = N2.V2
NEDTA ×V2 = NCa×VCa
0.01×18.2 = NCa×20
NCa = 0.0091
NEDTA ×(V1-V2) = NMg×VMg
0.01×(39.1-18.2) = NMg×20
NMg = 0.01
حجم فایل : 16کیلو بایت | فرمت فایل ها :doc. | زبان : فارسی
لینک دانلود | پسورد فایل : kimiagari.ir
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 9275 تاريخ : سه شنبه 29 آذر 1390 ساعت: 13:41
ژول" با آزمایش نشان داد که هرگاه مقدار معینی از انرژی مکانیکی به گرما تبدیل شود، مقدار گرمای حاصل همیشه یکسان است. بنابراین همارزی گرما و کار مکانیکی بهعنوان دو شکل انرژی ، کاملا محرز است. "هلمهولتز" اولین کسی بود که بوضوح بیان کرد که نهتنها گرما و انرژی مکانیکی ، بلکه تمام شکلهای انرژی همارزند و مقدار معینی از یک شکل انرژی از بین نمیرود، مگر آنکه همان مقدار در یکی از شکلهای دیگر انرژی ظاهر شود، بنابراین گرما صورتی از انرژی است.
گزارش کارآزمایشگاه شیمی فیزیک
موضوع آزمایش تعیین ظرفیت گرمایی ویژه
هدف آزمایش بدست آوردن ظرفیت گرمایی ویژه یک نمونه مجهول
مقدمه:
ژول" با آزمایش نشان داد که هرگاه مقدار معینی از انرژی مکانیکی به گرما تبدیل شود، مقدار گرمای حاصل همیشه یکسان است. بنابراین همارزی گرما و کار مکانیکی بهعنوان دو شکل انرژی ، کاملا محرز است. "هلمهولتز" اولین کسی بود که بوضوح بیان کرد که نهتنها گرما و انرژی مکانیکی ، بلکه تمام شکلهای انرژی همارزند و مقدار معینی از یک شکل انرژی از بین نمیرود، مگر آنکه همان مقدار در یکی از شکلهای دیگر انرژی ظاهر شود، بنابراین گرما صورتی از انرژی است.
حال اگر چنانچه بخواهیم دمای جسمی را به اندازه واحد افزایش دهیم، در این صورت بسته به نوع جسم ، این مقدار گرما متفاوت خواهد بود. کلمه ظرفیت در ظرفیت گرمایی بویژه گمراه کننده است، چون عبارت مقدار گرمایی را که یک جسم میتواند نگه دارد، به یاد میآورد که اساسا بیمعنا است.اصولا میتوان ظرفیت گرمایی را بهعنوان یک ثابت تناسب در نظرگرفت، یعنی مقدار گرمای داده شده به یک جسم با تغییر دمای آن جسم متناسب است و با ضرب کردن ظرفیت گرمایی در طرف دوم این رابطه ، رابطه تناسبی به یک تساوی تبدیل میشود، یعنی نسبت مقدار انرژی گرمایی که به یک جسم داده میشود، بر افزایش دمای متناظر با آن را ظرفیت گرمایی آن جسم میگویند به عبارت دیگر نسبت گرمای مبادله شده با سیستم به تغییر دمای ناشی از مبادله گرما را ظرفیت گرمایی می گویند.
مفهوم ظرفیت گرمایی فقط درمواردی به کارمیرود که مبادله گرما با سیستم تنها باعث تغییر دمای سیستم شود و در مواردی که تغییرفاز ایجادمیشود، به کارنمیرود.
ظرفیت گرمایی واحد جرم یک جسم را ظرفیت گرمایی ویژه آن جسم و ظرفیت گرمایی به ازای یک مول از ماده را ظرفیت گرمایی مولی می گویند.
تئوری آزمایش:
گرما از طریق آثار آن بر جسمی که از آن عبور می کند بررسی می شود. می توان تصور کرد که هر جسم ظرفیتی برای گرما دارد. هر چه در یک جسم تغییر دما به علت انتقال مقدار مشخصی از گرما کم تر باشد، ظرفیت آن بیش تر است. در واقع ظرفیت گرمایی را می توان به صورت زیر تعریف کرد:
مشکل این رابطه این است که C را، مانند Q، به جای یک تابع حالت، یک کمیت وابسته به فرایند می کند. اما، این امکان را می دهد که بیش از یک ظرفیت گرمایی مفید تعریف شود.
در واقع دو ظرفیت گرمایی برای سیالات همگن بسیار مورد استفاده است؛ که البته، هر دو توابع حالت بوده، و به روشنی در رابطه با سایر توابع حالت تعریف می شود:
ظرفیت گرمایی در حجم ثابت:
ظرفیت گرمایی در فشار ثابت:
این تعاریف بسته به اینکه U و H خواص مولی یا ویژه باشد، با ظرفیت های گرمایی مولی و ظرفیت های گرمایی ویژه (که معمولاً گرمای ویژه خوانده می شود) منطبق است.
ظرفیت گرمایی
انرژی داخلی ماده با افزایش دما زیاد می شود. این افزایش به شرایطی بستگی دارد که گرما داده می شود. در حال حاضر حجم نمونه را ثابت فرض خواهیم کرد، مانند گازی که در ظرفی با حجم ثابت محبوس شده است. اگر نمودار انرژی داخلی بر حسب دما رسم شود نموداری مانند شکل 1 به دست می آید. شیب این منحنی در هر دمایی را ظرفیت گرمایی سیستم در آن دما می نامند. ظرفیت گرمایی در حجم ثابت را با CV نمایش می دهند و چنین تعریف می شود:
در این مورد، انرژی داخلی با دما و حجم نمونه تغییر می کند، اما چون به تغییرات آن نسبت به دما علاقمندیم، حجم را ثابت نگاه می داریم. (شکل 2)
شکل 1 - با افزایش دما انرژی داخلی سیستم زیاد می شود. در این نمودار تغییرات آن در حجم ثابت نشان داده شده است. شیب نمودار در هر دمایی که به صورت خطوط مماس در A و B نشان داده شده اند ظرفیت گرمایی در حجم ثابت در آن دماست. توجه کنید که برای سیستم مورد نظر، ظرفیت گرمایی در B بزرگتر از مقدار آن در A است.
شکل 2 - انرژی داخلی با دما و حجم تغییر می کند، که به صورت یک سطح در این جا نشان داده شده است. تغییر انرژی داخلی با دما در حجم ثابت خاصی با منحنی¬ای نشان داده شده که به موازات محور T ترسیم شده است. از شیب این منحنی در هر نقطه مشتق جزئی معین می شود.
ظرفیت های گرمایی خواص مقداری اند: مثلاً ظرفیت گرمایی g100 آب صد برابر ظرفیت گرمایی g1 آب است (و لذا برای افزایش دمای آن به مقدار معینی صد برابر انرژی گرمایی لازم دارد). ظرفیت گرمایی مولی در حجم ثابت CV.m=CV/n، ظرفیت گرمایی به ازای یک مول ماده است که یک خاصیت شدتی است (تمام خواص مولی شدتی اند). مقدار CV.m، نوعی گازهای چند اتمی به CV.m=25JK-1mol-1 نزدیک است. برای بعضی کاربردها، دانستن ظرفیت گرمایی ویژه (به طرز غیررسمی تر «گرمای ویژه») مواد لازم است. این کمیت به صورت ظرفیت گرمایی ماده بخش بر جرم آن، و به طور معمول بر حسب گرم، CV.s=CV/m تعریف می شود. ظرفیت گرمایی ویژه آب در دمای اطاق حدود 4JK-1g-1 است. ظرفیت های گرمایی عموماً به دما وابسته هستند و در دماهای پایین تر کوچک ترند. با وجود این دردمای اطاق در محدوده های کوچک بالاتر از آن تغییر ظرفیت گرمایی با دما جزئی بوده و برای محاسبات تقریبی می توان مستقل از دما فرض کرد.
با استفاده از ظرفیت گرمایی می توان تغییر انرژی داخلی را به تغییر دمای سیستمی ربط داد که حجم آن ثابت می ماند. از معادله زیر دارم:
(در حجم ثابت) dU=CVdT
یعنی، تغییرات بسیار کوچک در دما موجب تغییرات بسیار کوچک در انرژی داخلی می شود و ثابت تناسب آن ظرفیت گرمایی در حجم ثابت است. اگر در محدوده¬ی دمایی موردنظر ظرفیت گرمایی مستقل از دما باشد، تغییرات دمایی ثابل اندازه گیری، ، ربط دارد:
(در حجم ثابت)
از آنجایی که تغییر انرژی داخلی را می توان از گرمایی داده شده در حجم ثابت مشخص کرد، معادله¬ی اخیر را می توان چنین نوشت:
بزرگ بودن ظرفیت گرمایی حاکی از این است که به ازای مقدار معینی از گرما افزایش دمای نمونه کوچک است (نمونه توانایی زیادی برای جذب گرما دارد). ظرفیت گرمایی نامحدود می رساند که مقدار گرما هم که داده شود افزایشی در دما ملاحظه نخواهد شد. در تبدیل فاز، مانند نقطه¬ی جوش آب، با وجود دادن گرما به سیستم، دما بالا نمی رود، انرژی صرف تبدیل فاز گرماگیر، مانند تبخیر آب، می شود به جای این که دما را افزایش دهد، بنابراین در دمای تبدیل فاز، ظرفیت گرمایی نمونه نامحدود است.
تغییر آنتالپی با دما
آنتالپی مواد با دما افزایش می یابد. ارتباط بین آنتالپی و افزایش دما به شرایط (مثلاً فشار ثابت یا حجم ثابت بستگی دارد. فشار ثابت مهمترین حالت است و شیب منحنی آنتالپی بر حسب دما در فشار ثابت ظرفیت گرمایی در فشار ثابت (Cp) نام دارد. (شکل 3)
از ظرفیت گرمایی در فشار ثابت می توان تغییر آنتالپی را به دما ربط داد.برای تغییرات بسیار کوچک دما،
در فشار ثابت
اگر ظرفیت گرمایی در محدوده ی دمایی مورد نظر ثابت باشد، سپس برای تغییرات دمایی قابل اندازه گیری،
در فشار ثابت
چون افزایش آنتالپی را می توان به گرمای داده شده در فشار ثابت ربط داد،شکل عملی معادله اخیر عبارت است از:
این عبارت نشان می دهد که چطور می توان ظرفیت گرمایی نمونه را اندازه گیری کرد:
مقدار گرمای قابل اندازه گیری در فشار ثابت به سیستم داده می شود (مثلاً موقعی که تحت فشار جو آزادانه منبسط می شود) و تغییر دما اندازه گیری می شود.
شکل 3 – شیب منحنی آنتالپی سیستم در فشار ثابت بر حسب دما، ظرفیت گرمایی در فشار ثابت را می دهد.شیب منحنی ممکن است با دما تغییر کند، که در این صورت ظرفیت کرمایی با دما تغییر می کند.بنا بر این ظرفیت گرمایی در A و B متفاوت است.برای گاز ها در یک دمای خاص شیب نمودار آنتالپی بر حسب دما از شیب نمودار انرژی داخلی بر حسب دما تند تر است، لذاCp,m از Cv,m بزرگ تر است.
ظرفیت گرمایی ویژه را میتوان از مشتقگیری از تغییرات آنتالپی سیستم نتیجه گرفت. به عبارت دیگر تغییرات آنتالپی سیستم همان انتگرال از ظرفیت حرارتی ویژه در محدوده دمایی مورد نظر است. ظرفیت گرمایی ویژه را در فشار ثابت از طریق کالریمتری سنجشی مقیاسی تعیین میکنند. ظرفیت گرمایی ویژه در جامدات بیشتر از مایعات و در مایعات بیشتر از گازها است. این مورد با استفاده از تئوری سینتیک مولکولی قابل توجیه است. مولکولها در گازها از سرعت حرکت بالایی برخوردارند و تغییر کمی در دمای یک گاز منجر به افزایش حجم آن میشود. به این دلیل ظرفیت گرمایی ویژه در گازها پایین است در حالی که افزایش حرکت مولکولها و حجم مایعات در اثر افزایش دما کمتر از گازهاست و بنابراین مایعات ظرفیت گرمایی ویژه بیشتری نسبت به گازها دارند. در مورد جامدات به دلیل آن که انرژی گرمایی بالایی باید به آنها داد تا حجمشان افزایش یابد ظرفیت گرمایی ویژه جامدات بیشتر از مایعات است.
چرا ظرفيت گرمايي ويژه H2>N2>O2 است ؟
ظرفيت گرمايي ويژه گازها به دو عامل جرم مولي و تعداد اتم ها در مولكول گاز بستگي دارد .
الف – هر چه جرم مولي گاز بيشتر باشد 1 گرم آن تعداد مولكول هاي كمتري دارد و انرژي لازم براي جنبش آن كمتر وظرفيت گرمايي ويژه آن كمتر است در نتيجه H2>N2>O2 است .
ب- هر چه تعداد اتم ها در مولكول يك گاز بيشتر باشد انرژي لازم براي جنبش آنها بيشتر و ظرفيت گرمايي ويژه آن بيشتر است .
مانند: NH3g> H2Og
عوامل موثر بر ظرفیت گرمایی
• جرم مولی
• پیوند هیدروژنی
• میزان فضای آزاد
ظرفیت گرمایی برای گازها :
برای گازهای کامل Cp - Cv = nR که R ثابت گازها است .
مسلما رابطه Cp - Cv = nR برای گاز های حقیقی که بین مولکول ها برهم کنش وجود دارد انحراف نشان خواهد داد. حالت ترمودینامیکی یک سیستم تعادلی درحالت سکون درغیاب میدان های خارجی توسط ترکیب آن ( تعدادمول های هرجزء موجود درهرفاز ) وتوسط دو متغیر ازسه متغیر P ٬T٬ V مشخص می شود.برای یک ماده خالص ظرفیت های گرمایی مولی در P ثابت و یا در V ثابت عبارت اند از :
Cp,m =n/ Cp و یا Cv,m =n/ Cv
هرچه تعداد راه هایی که ماده بتواندانرژی کسب کند(انتقال٬ چرخش٬ نوسان و برهم کنش های بین مولکولی) بیشتر باشد ٬ مقادیر Cp,m و Cv,mبزرگتر خواهد بود.
مقدار زیاد Cp,m آب مایع ٬ درمقایسه با بخار آب درنتیجه سهم برهم کنش های بین مولکولی در انرژی درونی (U)است.معمولا Cp برای مایع یک ماده به طور قابل توجهی بزرگتر ازبخار همان ماده است.
بدیهی است برای یک سیستم تک فازی Cp,m با افزایش اندازه مولکول ها زیاد می شود. برای یک سیستم تک فازی باجرم m ظرفیت گرمایی ویژه cp( که اغلب گرمای ویژه نامیده می شود) عبارت است٬ از ظرفیت گرمایی تقسیم بر جرم cp =m /Cp
واژه " ویژه " برای واحد جرم به کار می رود. وبنابراین حجم ویژه v و آنتالپی ویژه h یک فاز به جرم m عبارت خواهد بود از : h ≡ H/m , v ≡V /m = /ρ1
ظرفیت گرمایی Cp ( که یک خاصیت مقداری است ) را با ظرفیت های گرمایی مولی( Cv,m و Cp,m ) یا ظرفیت گرمایی ویژه cp ( که خواص شدتی هستند ) نباید اشتباه نمود.
ماده خالص Cp,m =n /Cp
سیستم تک فازی cp =/m Cp
به این ترتیب می توان نتیجه گرفت گرمای ویژه یک ماده به ساختارمولکولی آن ماده ونیروی های بین مولکولی و دما و فشار یاحجم سیستم بستگی دارد. درمورد مولکول هایی نظیر آب که نیروی بین مولکولی نسبتا قوی هیدروژنی بین مولکول ها حتی درحالت گاز وجود دارد٬ موارد غیر عادی به چشم می خورد.
مقدار انرژی درونی به ازای هر درجه انتقالی 1/2RT و برای سه درجه آزادی 3/2RT می باشد که Cv=3/2R و Cp=5/2R بدست می آید به عنوان مثال برای گاز ایده ال هلیم به صورت زیر محاسبه می شود :
Cp=5/2R=5/2(8.314)=20.8J/mol.k
مقدار انرژی درونی به ازای هر درجه آزادی چرخشی 1/2RT تعریف می شود لذا برای مولکول های H2,N2,O2 به علت وجود دو حرکت چرخشی Cp=7/2R=29.1j/k.mol تفاوت جزیی مفادیر داده شده به نوع پیوند مولکول مربوط است .در مولکول هایی مانند بخار آب و آمونیاک با افزایش تعداد پیوند و درجات آزادی مقدار Cp افزایش می یابد .
ظرفیت گرمایی برای مایعات :
در مایعات به دلایل نا معلومی انرژی درونی 3/2RT به 3/2R تبدیل می شود و برای توجیه تفاوت مقادیر Cp مایعات داده شده در جدول تعداد پیوند ها و نیرو های جاذبه مولکولی مانند پیوند هیدروژنی را باید مد نظر قرار داد .
ظرفیت گرمایی برای جامدات :
طبق قانون دولن و پتی ( ظرفیت گرمایی x جرم اتمی = 25ژول) خواهد بود ( در جامداتی مانند یخ ؛ سدیم کلرید و گرافیت تراکم مولکول ها و رسانای خوب گرما را باید مد نظر قرار داد ) بنابراین عوامل موثر بر ظرفیت گرمایی عبارتند از :
1- نوع ماده 2- شرایط واکنش (حجم ثابت یا فشار ثابت ) 3- مقدار ماده 4- دما
در ضمن ظرفیت گرمایی کل ( Ct ) برابر با مجموع ظرفیت های گرمایی : حرکات انتقالی، چرخشی و ارتعاشی می باشد.
تفاوت ظرفيت گرمايي ويژة آب درسه حالت جامد، مايع وگاز:
در يخ مولكول ها در جاهاي نسبتا ثابتي قرار دارند و تنها داراي حركت هاي ارتعاشي هستند و هنگامي كه به آن گرما مي دهيم ، گرما ارتعاش مولكول ها را افزايش مي دهد و دماي آن بالا مي رود . اگر به آب مايع گرما بدهيم مقداري از گرما صر ف شكستن پيوند هيدروژني بين مولكول ها مي شود و مقداري هم صرف جنبش مولكول ها مي شود در نتيجه براي آب مايع گرماي بيشتري مصرف مي شود و ظرفيت گرمايي ويژه آن بيشتر از يخ است . در مورد بخار آب كه مولكول ها از يكديگر جدا هستند ، گرماي داده شده صرف جنبش مولكول ها مي شود و دما افزايش مي يابد . بنابراين ظرفيت گرمايي ويژه بخار آب كمتر از آب مايع است .
.
شرح آزمایش:
ابتدا جرم دو لوله آزمایش مشابه را توسط ترازو اندازه می گیریم .در یک لوله آزمایش مقداری آب می ریزیم و در لوله¬ی دیگر به همان اندازه مایع موردنظر را ریخته و جرم هر دو لوله حاوی آب و ماده مورد نظر را اندازه گیری می کنیم. لوله ها را به طور قائم به یک اندازه در آبی که در بشری قرار دارد فرو برده و آنها را توسط گیره به یک پایه محکم می کنیم. (شکل پایین) عمل حرارت دادن را شروع می کنیم تا اینکه آب درون بشر و در نتیجه لوله ها و محتویات آنها گرم می شوند. حرارت دادن را تا حدی که دمای آنها پایین تر از نقطه جوش آب و مایع موردنظر باشد ادامه می دهیم. سپس بشر را دور کرده و می گذاریم تا لوله ها سرد شوند. چون گرمای ویژه آب و مایع موردنظر متفاوت است، سرعت سرد شدن آنها یکسان نخواهد بود. دمای هر یک از لوله ها را هر20 ثانیه یک بار قرائت و درجدول مربوطه ثبت می کنیم. موقعی که دما به میزان کمی بیشتر از دمای محیط رسید عمل را متوقف می کنیم. منحنی تغییرات دما را نسبت به زمان برای هر دو مایع رسم می کنیم. (نمودار پایین)
برای آب در زمان t1 افت دما و برای مایع موردنظر در زمان t2 افت دما خواهد بود (تغییر دما را روی محور به یک اندازه اختیار می کنیم).
زمانهای t1 و t2 را از روی منحنی بدست می آوریم. مقدار انرژی حرارتی که لوله و آب محتوی آن از دست داده اند برابر است با:
و مقدار گرمایی که لوله و مایع موردنظر از دست داده اند برابر است با:
از تقسیم دو رابطه به یکدیگر نتیجه می شود:
از طرفی چون می باشد، در نتیجه خواهیم داشت:
m1 و c1 جرم و گرمای ویژه آب، m2 و c2 جرم و گرمای ویژه مایع موردنظر و و جرم و گرمای ویژه لوله¬ی آزمایش است. با توجه به اینکه گرمای ویژه شیشه است تمام مقادیر به جز c2 معلومند.
2. بحث و نتیجه گیری
اگر دو جسم در شرایط مشابه به یک اندازه سرد شوند(تغییر دما برای هر دو یکسان باشد) جسمی که دارای گرمای ویژه کمتری است زود تر و و دیگری دیر تر سرد می شود، به عبارت دیگر هر چه ظرفیت گرمایی یک ماده بیشتر باشد، آن جسم دیرتر گرم شده و وقتی گرم شد دیرتر سرد می شود.
3. خطا
8-1 موارد خطا
الف) بدلیل آرام نبودن محیط و جریان داشتن نا مساوی هوا روی لوله های آزمایش، سرعت سرد شدن لوله ها یکسان نمی باشد.
ب) نزدیک شدن دماسنج به دیواره یا کف لوله آزمایش که در نتیجه آن دماسنج دمای بیشتری را نشان می دهد.
ج) در طول آزمایش مقداری از نمونه و آب تبخیر می شوند که در محاسبات به حساب نمی آیند.
د) حجم نمونه و آب مقطر زیاد باشد.
8-2 دلایل خطا
الف) به علت رفت آمد افراد و همچنین جریان داشتن باد در محیط آزمایشگاه، جریان هوا به طور یکنواخت در لوله ها توزیع نشده و سرعت سرد شدن یکسان نمی باشد.
ب) بدلیل صاف نبودن سوراخ درپوش لاستیکی دماسنج به طور عمود در لوله قرار نگرفته و به جداره لوله آزمایش نزدیک می شود.
ج) چون عمل تبخیر در هر دمایی صورت می گیرد لذا مقداری از آب و نمونه در طول آزمایش تبخیر می شوند.
د) اگر حجم نمونه و آب مقطر زیاد باشد، برای قرار دادن آنها در حمام باید طول زیادی از لوله آزمایش در آب قرار گیرد که در نتیجه آن ته لوله آزمایش به کف بشر نزدیک شده و دما به طور ناگهانی افزایش یافته و همچنین توزیع گرما در سطح لوله آزمایش و نمونه به طور یکسان نخواهد بود.
8-3 پیشنهادات جهت رفع خطا
الف) انجام دادن آزمایش در یک محیط محصور.
ب) استفاده از درپوش لاستیکی استاندارد که سوراخ آن صاف باشد.
ج) میتوان به کمک یک درپوش لاستیکی محکم درب لوله آزمایش را محکم کرده و از خروج مایعات تبخیر شده جلوگیری کرد.
د) حجم آب و مایع نمونه باید متناسب با حجم و ارتفاع حمام آب گرم باشد
مراجع و منابع
کتب
کتاب ترمودینامیک مهندسی شیمی/ اسمیت ونس / محمد مهدی منتظر رحمتی / ویراست پنجم
لینک دانلود | پسورد فایل : kimiagari.i
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 6064 تاريخ : سه شنبه 22 آذر 1390 ساعت: 19:26
آرشیو مطالب
- اسفند 1386
- مهر 1386
- آبان 1386
- دی 1387
- بهمن 1387
- اسفند 1387
- فروردين 1387
- خرداد 1387
- مهر 1387
- آبان 1387
- آذر 1387
- بهمن 1388
- اسفند 1388
- فروردين 1388
- ارديبهشت 1388
- خرداد 1388
- تير 1388
- شهريور 1388
- آبان 1388
- بهمن 1389
- اسفند 1389
- فروردين 1389
- ارديبهشت 1389
- خرداد 1389
- تير 1389
- شهريور 1389
- مهر 1389
- آبان 1389
- دی 1390
- بهمن 1390
- اسفند 1390
- فروردين 1390
- ارديبهشت 1390
- خرداد 1390
- مرداد 1390
- شهريور 1390
- مهر 1390
- آبان 1390
- آذر 1390
- دی 1391
- بهمن 1391
- اسفند 1391
- فروردين 1391
- ارديبهشت 1391
- تير 1391
- مرداد 1391
- شهريور 1391
- مهر 1391
- آبان 1391
- آذر 1391
- بهمن 1392
- اسفند 1392
- فروردين 1392
- تير 1392
- مرداد 1392
- شهريور 1392
- آبان 1392

